【第61期】前沿靶點速遞:每周醫學研究精選
日期:2025-10-28 14:11:01
01、靶點:AHNAK
應用:阿爾茨海默病治療新的靶點
來源:Multiscale proteomic modeling reveals protein networks driving Alzheimer’s disease pathogenesis.Cell,2025 Sep 25
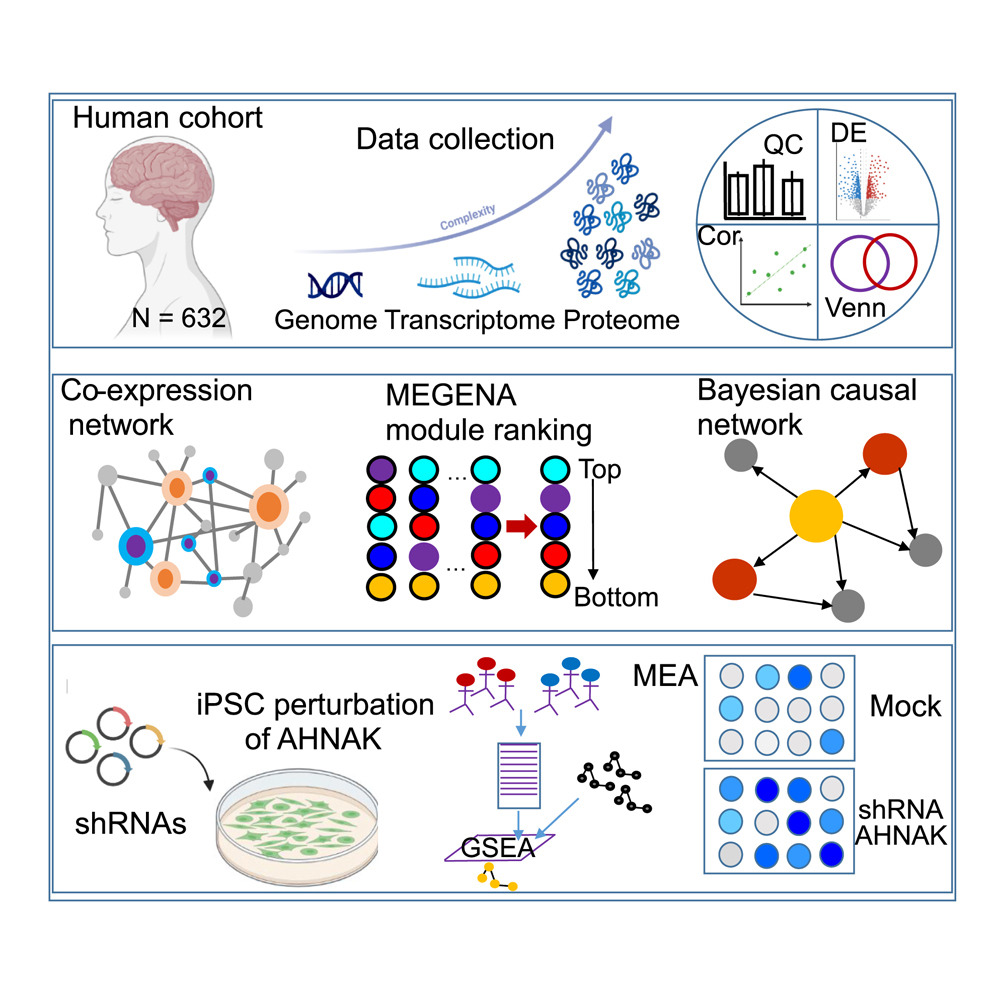
圖源:10.1016/j.cell.2025.08.038[1]
《Cell》雜志發表的研究通過多組學技術深入分析阿爾茨海默病(AD)患者大腦的蛋白質網絡,發現海馬旁回是關鍵受損區域。研究鑒定出12,147種蛋白質亞型,發現超過1000種蛋白質在AD患者中顯著變化。構建的蛋白質共表達網絡顯示,星形膠質細胞和小膠質細胞的標志性蛋白顯著上調,而神經元相關蛋白下調。進一步分析鎖定AHNAK為關鍵驅動蛋白,其在星形膠質細胞中高表達且與疾病進展密切相關。實驗表明,沉默AHNAK可降低星形膠質細胞的毒性,改善神經元功能。該研究為AD治療提供了新的靶點和研究方向,標志著AD研究進入系統生物學新時代。
02、靶點:USP5
應用:急性髓系白血病(AML)的治療
來源:USP5 inhibition enables potential therapy for t(8;21) AML through ubiquitin-mediated AML1-ETO degradation in patient-derived xenografts.Sci Transl Med,2025 Sep 24

圖源:10.1126/scitranslmed.adt9100[2]
南開大學楊光、楊誠團隊在《Science Translational Medicine》發表研究,探索急性髓系白血病(AML)靶點及靶向藥物治療的臨床轉化進展。研究聚焦于AML中常見的t(8;21)染色體易位產生的AML1-ETO融合蛋白,該蛋白是AML治療的關鍵潛在靶點,但因“不可成藥”特性限制了小分子藥物研發。團隊通過篩選發現USP5是AML1-ETO的專屬去泛素化酶,其通過去泛素化修飾維持AML1-ETO蛋白穩定性,促進AML細胞惡性增殖。研究進一步設計并篩選出高選擇性USP5抑制劑WCY-8-67,實驗表明其在細胞和動物模型中均能有效抑制AML細胞增殖,延長生存期且安全性良好,目前已進入臨床前研究階段。該研究為“不可成藥”靶點的靶向干預和去泛素化酶抑制劑的開發提供了新策略和思路。
03、靶點:TAAR1
應用:助力開發抗冰毒成癮新藥
來源:β2AR as a target in methamphetamine addiction: Divergent mechanisms from TAAR1.Cell Rep,2025 Sep 23
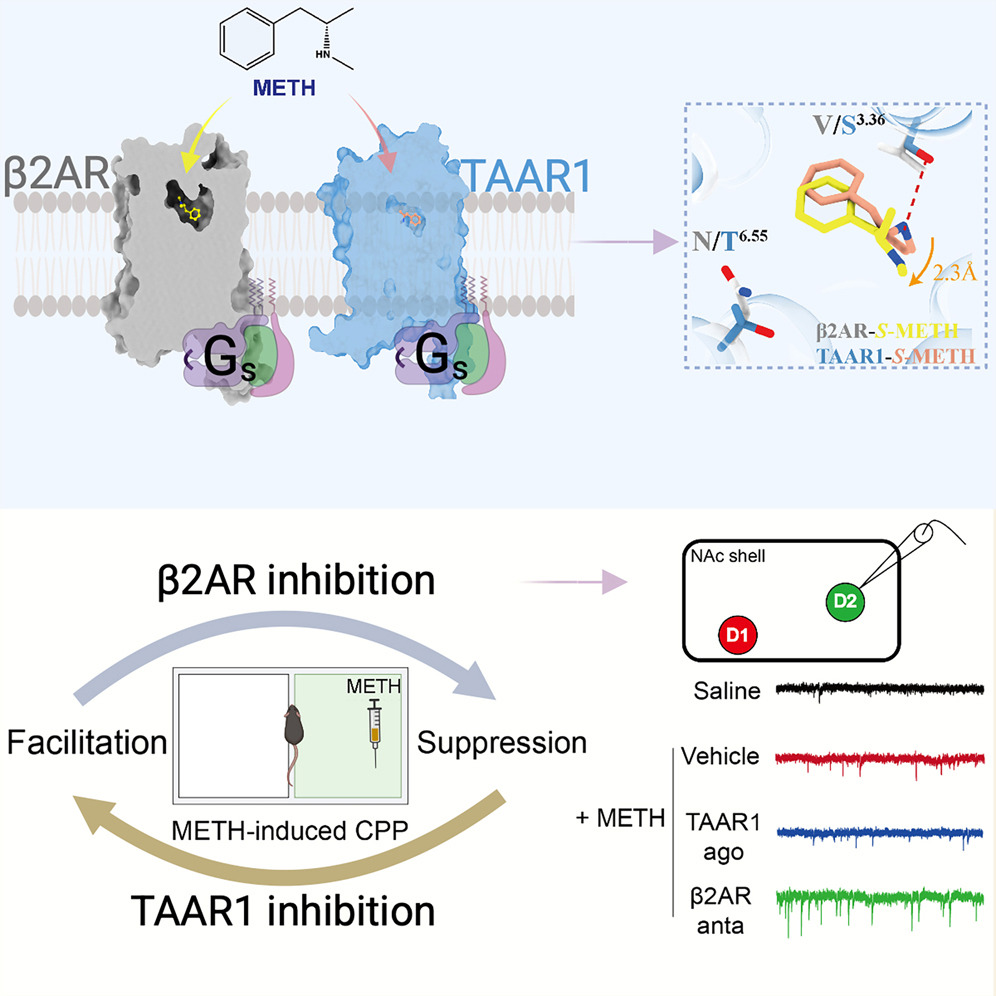
圖源:10.1016/j.celrep.2025.116337[3]
2025年9月24日,天津大學喬安娜、葉升團隊聯合湖北大學和北京大學在《Cell Reports》發表研究,揭示冰毒成癮新靶點。研究發現β2腎上腺素受體(β2AR)是冰毒的直接作用靶點,與已知靶點TAAR1在調控冰毒成癮中作用機制截然不同。團隊通過冷凍電鏡解析冰毒與β2AR復合物結構,揭示其結合機制。實驗表明,抑制β2AR可阻止冰毒獎賞記憶形成,而抑制TAAR1則促進成癮記憶。β2AR拮抗劑通過增強大腦伏隔核殼區特定神經元興奮性輸入改變突觸可塑性,抑制成癮記憶。該研究厘清了β2AR與TAAR1在成癮機制中的辯證關系,為開發抗冰毒成癮新藥提供重要依據,且因β2AR已有臨床應用藥物,新藥研發有望加速。
04、靶點:ATAD3A
應用:作為線粒體精準氧化還原調控分子的新功能
來源:ATAD3A deficiency induces oxidative eustress via the complex I reverse electron transport.Free Radic Biol Med,2025 Sep 15
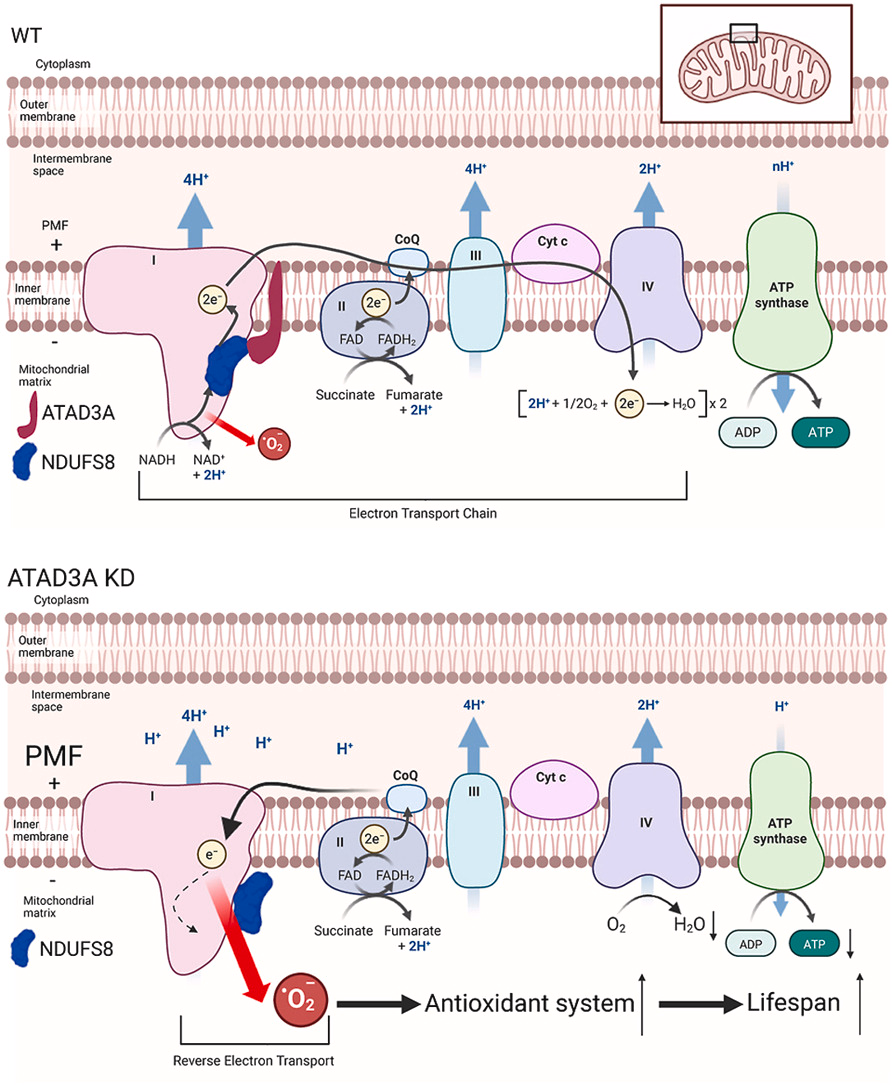
圖源:10.1016/j.freeradbiomed.2025.09.027[4]
中國科學院生物物理研究所陳暢課題組在《Free Radical Biology and Medicine》雜志發表研究,發現ATAD3A作為線粒體精準氧化還原調控分子的新功能。研究通過全基因組RNAi篩選發現,敲低ATAD3A可顯著增加線粒體ROS水平。機制研究表明,ATAD3A與線粒體復合體I亞基NDUFS8相互作用,調控復合體I的組裝和活性。敲低ATAD3A會降低復合體I活性,增加線粒體膜電勢,誘導反向電子傳遞(RET)產生更多ROS。這些ROS作為保護性信號,激活抗氧化系統,增強線蟲抗逆性和壽命。該研究揭示了ATAD3A缺陷通過誘導RET-ROS發揮有益作用的新機制,強調了“精準氧化還原”理念的重要性。
05、靶點:TREX1
應用:為理解天然免疫調控機制提供了新見解
來源:Gigaxonin Potentiates Antiviral Innate Immune Responses by Targeting cGAS and TREX1.Adv Sci (Weinh),2025 Sep 11
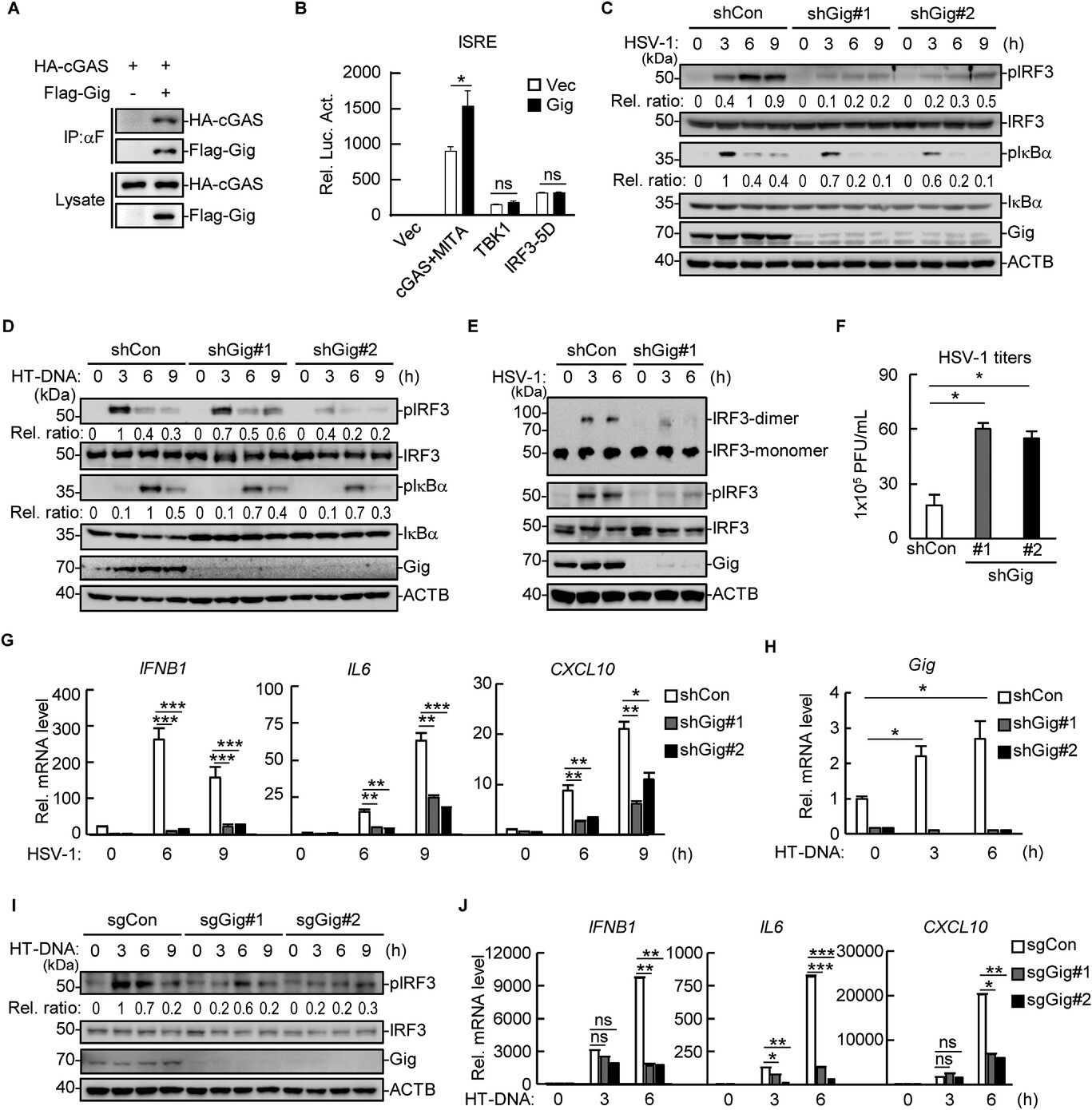
圖源:10.1002/advs.202507146[5]
武漢大學劉昱團隊在《Advanced Science》發表研究,揭示gigaxonin通過靶向cGAS和TREX1增強抗病毒天然免疫反應。研究發現,gigaxonin在無病毒感染時通過介導TREX1泛素化降解維持細胞穩態;病毒感染后,gigaxonin快速轉向結合cGAS,增強其泛素化修飾和酶活性,從而增強抗病毒反應。實驗表明,敲低或敲除gigaxonin會削弱細胞和小鼠的抗病毒能力,降低干擾素和炎癥因子水平,增加病毒復制。研究還發現,gigaxonin通過其底物識別結構域識別cGAS和TREX1,介導CRL3復合體催化它們的泛素化。該研究為理解天然免疫調控機制提供了新見解。
06、靶點:USP14
應用:肝癌免疫治療
來源:USP14-mediated metabolic competition impairs CD8+ T cell immunosurveillance in hepatocellular carcinoma.Proc Natl Acad Sci U S A,2025 Sep 23
圖源:10.1073/pnas.2510576122[6]
中山大學腫瘤防治中心李斌奎團隊在《PNAS》發表研究,揭示泛素特異性蛋白酶USP14是肝癌免疫治療耐藥的關鍵調控基因。研究通過CRISPR篩選體系發現USP14高表達的肝癌患者對抗PD-1治療反應較差,且腫瘤中CD8+ T細胞浸潤減少。機制研究表明,USP14通過去泛素化修飾葡萄糖轉運蛋白GLUT1,增強其穩定性并促進葡萄糖攝取,導致腫瘤微環境中葡萄糖匱乏,抑制CD8+ T細胞的代謝活性和功能。實驗表明,抑制USP14可恢復CD8+ T細胞功能,并與抗PD-1治療產生協同抗腫瘤效果。該研究為肝癌免疫治療提供了新的生物標志物和聯合治療策略,有望提升治療響應率。
07、靶點:LRP8
應用:蜱傳腦炎病毒(TBEV)的治療
來源:LRP8 is a receptor for tick-borne encephalitis virus.Nature,2025 Oct

圖源:10.1038/s41586-025-09500-2[7]
2025年9月24日,卡羅林斯卡醫學院等機構合作在《Nature》發表研究,發現LRP8是蜱傳腦炎病毒(TBEV)的特異性受體。研究通過CRISPR-Cas9全基因組篩選,鑒定出LRP8的LA1–2結構域能與TBEV的E蛋白DIII高親和力結合,驅動病毒黏附與內吞。基于此機制設計的可溶性LA1–2–Fc誘餌蛋白,能在體外阻斷TBEV感染,并在小鼠模型中提供顯著保護,存活率接近100%。該研究不僅揭示了TBEV入侵神經系統的分子機制,還為開發特異性抗病毒治療提供了新靶點和策略。
08、靶點:FLT3LG
應用:急性髓系白血病(AML)的治療
來源:FLT3L-based drug conjugate effectively targets chemoresistant leukemia stem cells in acute myeloid leukemia.Cell Rep Med,2025 Oct 21

圖源:10.1016/j.xcrm.2025.102365[8]
中山大學附屬第七醫院陳韻、陳純團隊在《Cell Reports Medicine》發表研究,開發了一種基于FLT3配體(FLT3L)的藥物偶聯物FL-Fc-DM1,用于治療急性髓系白血病(AML)。該偶聯物通過FLT3介導的內吞作用,將細胞毒性藥物DM1遞送至AML細胞,有效靶向化療耐藥的白血病干細胞。實驗表明,FL-Fc-DM1在體外、體外培養以及細胞系和患者來源的異種移植模型中均展現出強大的抗白血病活性,能顯著降低白血病干細胞頻率,并通過BH3模擬物進一步增強治療效果。重要的是,該藥物在治療劑量下對正常造血功能影響有限,顯示出良好的安全性,為AML治療提供了新的候選藥物。
09、靶點:GTF2H4
應用:缺血性疾病的血管重建治療的新靶點
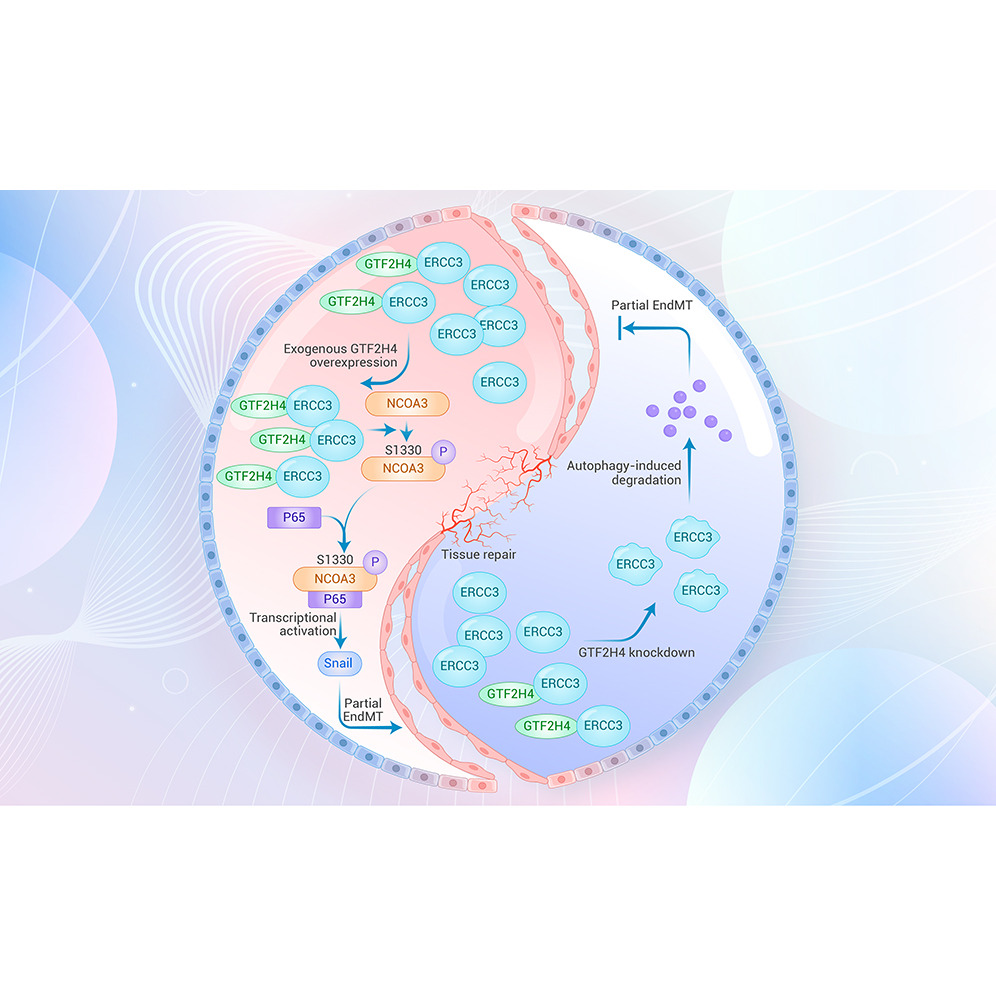
來源:GTF2H4 regulates partial EndMT via NF-κB activation through NCOA3 phosphorylation in ischemic diseases.Innovation (Camb),2024 Mar 04
圖源:10.1016/j.xinn.2024.100565[9]
復旦大學附屬中山醫院葛均波院士、李華研究員團隊在《The Innovation》發表研究,揭示轉錄因子GTF2H4通過與ERCC3協同作用,促進內皮細胞在缺氧微環境中發生部分內皮-間質轉化(partial EndMT),并激活NF-κB/Snail信號軸。研究發現,GTF2H4在缺血性損傷后顯著促進部分EndMT和血管生成,改善缺血組織的血流重建能力。該研究為缺血性疾病的血管重建治療提供了新的靶點和策略。
10、靶點:MDA5(IFIH1)
應用:治療MDA5相關自身免疫疾病的新靶點
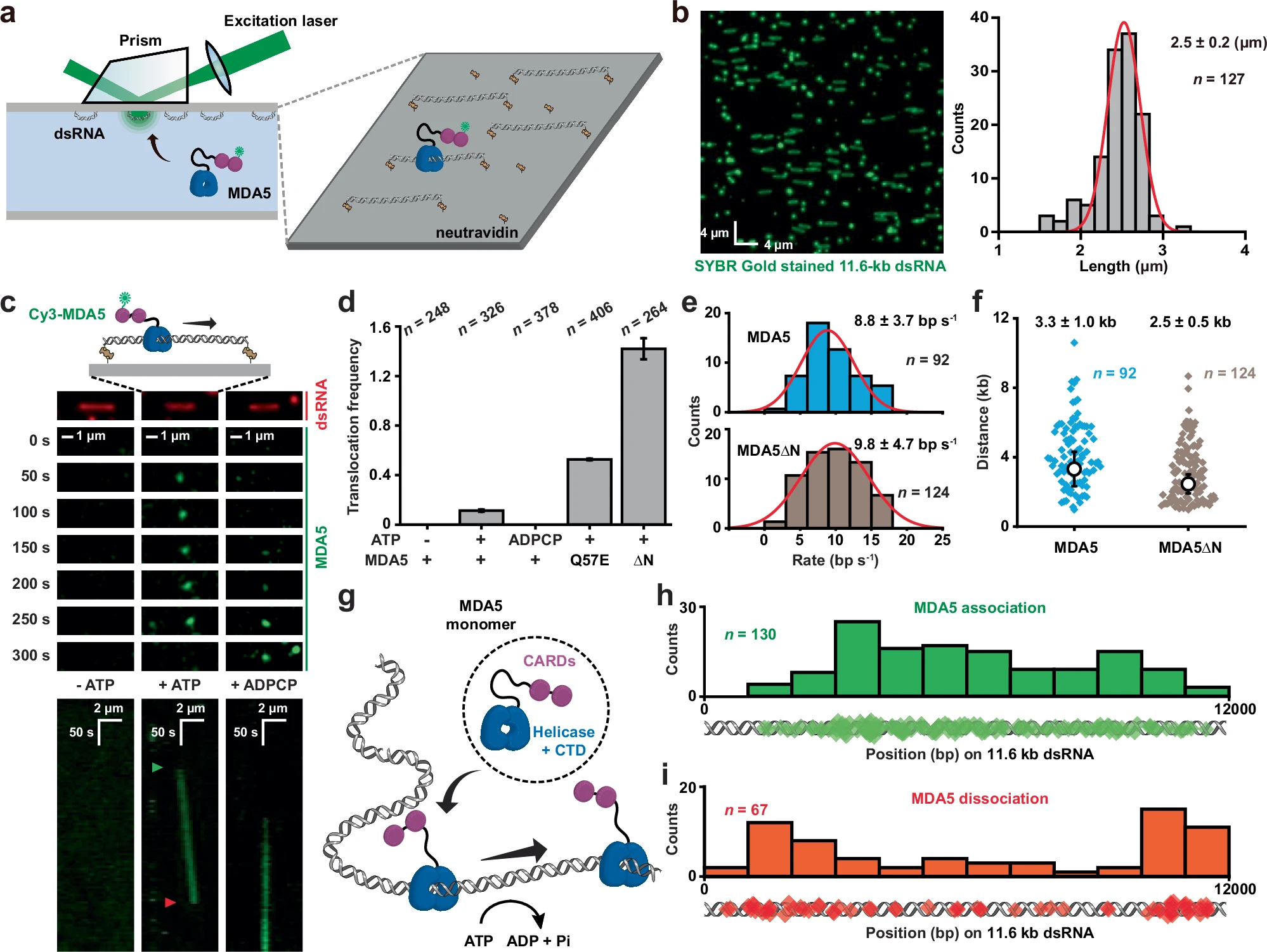
來源:ATP-dependent one-dimensional movement maintains immune homeostasis by suppressing spontaneous MDA5 filament assembly.Cell Res,2025 Sep 19
圖源:10.1038/s41422-025-01183-8[10]
中國科學院分子細胞科學卓越創新中心劉珈泉團隊與中國科學院上海免疫與感染研究所鐘勁團隊合作在《Cell Research》發表研究,揭示MDA5通過ATP水解驅動的易位運動(translocation)防止異常filament形成,從而維持免疫穩態。研究利用單分子成像技術發現,MDA5作為分子馬達沿dsRNA運動,缺乏ATP時運動停止,導致異常激活和自身免疫疾病。LGP2可識別運動中的MDA5并抑制其活性,促進microfilament組裝啟動抗病毒反應。該研究建立了“ATP水解驅動的translocation—抑制filament組裝—維持免疫穩態”的因果鏈條,為治療MDA5相關自身免疫疾病提供了新靶點。
推薦產品
| 靶點 | 重組蛋白 | 貨號 |
| AHNAK | Recombinant Human Neuroblast differentiation-associated protein AHNAK (AHNAK), partial | CSB-MP600257HU |
| ATAD3A | Recombinant Human ATPase family AAA domain-containing protein 3A (ATAD3A), partial | CSB-MP878897HU1 |
| FLT3LG | Recombinant Human Fms-related tyrosine kinase 3 ligand (FLT3LG), partial | CSB-EP008734HU1 |
| GTF2H4 | Recombinant Human General transcription factor IIH subunit 4 (GTF2H4) | CSB-MP838803HU |
| IFIH1 | Recombinant Human Interferon-induced helicase C domain-containing protein 1 (IFIH1), partial | CSB-EP880143HU |
| LRP8 | Recombinant Human Low-density lipoprotein receptor-related protein 8 (LRP8), partial | CSB-MP623900HU |
| TAAR1 | Recombinant Human Trace amine-associated receptor 1 (TAAR1) | CSB-CF847217HU |
| TREX1 | Recombinant Human Three-prime repair exonuclease 1 (TREX1), partial | CSB-EP865133HU1 |
| USP14 | Recombinant Human Ubiquitin carboxyl-terminal hydrolase 14 (USP14) | CSB-EP025704HU |
| USP5 | Recombinant Human Ubiquitin carboxyl-terminal hydrolase 5 (USP5), partial | CSB-MP025742HU |
參考文獻
[1]Multiscale proteomic modeling reveals protein networks driving Alzheimer’s disease pathogenesis.Cell,2025 Sep 25













