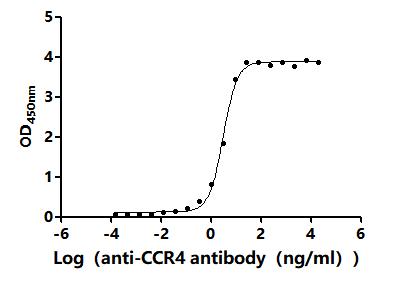
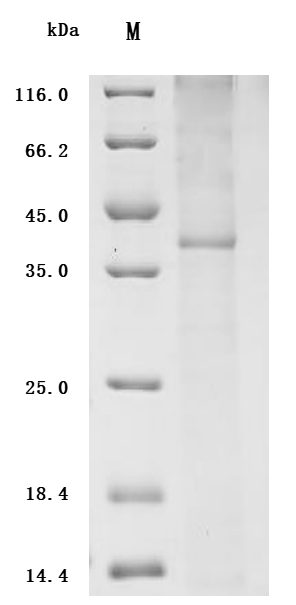
去垢劑技術(shù)平臺
1. 背景和基本原理
跨膜蛋白在細胞功能調(diào)控和信號傳導(dǎo)中發(fā)揮著重要作用,在生物學(xué)研究和藥物開發(fā)中具有極高的價值 [1]。然而,傳統(tǒng)的表達系統(tǒng)很難實現(xiàn)跨膜蛋白的有效表達和提取,這主要是由于跨膜蛋白具有復(fù)雜的空間結(jié)構(gòu)和疏水性特征 [2]。去垢劑技術(shù)平臺,通過在細胞膜上形成洗滌劑小分子團簇(detergent micelle),模擬細胞膜的環(huán)境,可實現(xiàn)跨膜蛋白的表達和提取 [3]。
2. 去垢劑技術(shù)與表達系統(tǒng)
去垢劑技術(shù)可以應(yīng)用于多種表達系統(tǒng),包括細菌、酵母、昆蟲細胞、哺乳動物細胞和無細胞表達系統(tǒng)。每種表達系統(tǒng)都有其獨特的優(yōu)缺點,需要根據(jù)實際需求進行選擇。
無細胞表達系統(tǒng)的優(yōu)點在于可以在較短的時間內(nèi)獲得目標蛋白,無需細胞培養(yǎng)和分離步驟,同時可以更好地控制實驗條件 [4]。應(yīng)用去垢劑技術(shù),無細胞表達系統(tǒng)可以通過添加合適的洗滌劑來實現(xiàn)跨膜蛋白的表達和穩(wěn)定 [5]。然而,無細胞表達系統(tǒng)在蛋白質(zhì)翻譯、折疊和修飾方面可能存在一定的局限性 [6]。
3. 跨膜蛋白的提取和純化
在使用去垢劑技術(shù)提取和純化跨膜蛋白時,關(guān)鍵的一步是選擇合適的洗滌劑。洗滌劑的類型、濃度和溫度等條件對跨膜蛋白的提取效果具有顯著影響 [7]。在實驗過程中,需要嘗試不同的洗滌劑,以優(yōu)化蛋白提取的效果。此外,純化方法的選擇也對最終獲得的跨膜蛋白質(zhì)量產(chǎn)生重要影響,可以采用諸如親和層析、離子交換層析和凝膠滲透層析等技術(shù) [8]。
4. 華美生物去垢劑平臺技術(shù)優(yōu)勢
華美生物在長期積累的跨膜蛋白表達和純化經(jīng)驗基礎(chǔ)上,通過多種去垢劑的選擇和聯(lián)合使用,可有效提高總蛋白中目的跨膜蛋白含量,且保證其構(gòu)象正確、穩(wěn)定。平臺優(yōu)勢特色如下:

- 可全長表達多次跨膜蛋白,不僅僅只限于ECD表位
- 可精確定量,區(qū)別于VLP和Nanodisc平臺
- 可應(yīng)用于免疫/ELISA/SPR/BLI
目前,華美生物通過改良的跨膜蛋白純化技術(shù),已成功開發(fā)出12次跨膜的SLC7A11等蛋白、7次跨膜的EDNRB、ACKR1、CCR2等蛋白、6次跨膜的AQPZ、AQP1等蛋白、5次跨膜的ABCD1等蛋白、3次跨膜的SLC31A1等蛋白以及1次跨膜的SLFN12L蛋白等稀缺產(chǎn)品。
參考文獻:
[1] Overington, J. P., Al-Lazikani, B., & Hopkins, A. L. (2006). How many drug targets are there? Nature Reviews Drug Discovery, 5(12), 993-996.
[2] Bill, R. M. (2015). Playing catch with membrane proteins. Science, 347(6226), 1072-1073.
[3] Zhang, M., & Chiu, C. (2019). Membrane protein structure determination using detergent micelle platforms. FEBS Journal, 286(2), 418-428.
[4] Smith, M. T., Hawes, A. K., & Bundy, B. C. (2013). Reengineering viruses and virus-like particles through chemical functionalization strategies. Current Opinion in Biotechnology, 24(4), 620-626.
[5] Shimizu, Y., Inoue, A., Tomari, Y., Suzuki, T., Yokogawa, T., Nishikawa, K., & Ueda, T. (2001). Cell-free translation reconstituted with purified components. Nature Biotechnology, 19(8), 751-755.
[6] Carlson, E. D., Gan, R., Hodgman, C. E., & Jewett, M. C. (2012). Cell-free protein synthesis: applications come of age. Biotechnology Advances, 30(5), 1185-1194.
[7] Seddon, A. M., Curnow, P., & Booth, P. J. (2004). Membrane proteins, lipids and detergents: not just a soap opera. Biochimica et Biophysica Acta (BBA) - Biomembranes, 1666(1-2), 105-117.
[8] Grisshammer, R., & Tate, C. G. (1995). Overexpression of integral membrane proteins for structural studies. Quarterly Reviews of Biophysics, 28(3), 315-422.