【第45期】前沿靶點速遞:每周醫學研究精選
日期:2025-06-25 13:47:35

01.靶點 DERL3
應用:肺腺癌治療
來源:Derlin-3 Manipulates the Endoplasmic Reticulum Stress and IgG4 Secretion of Plasma Cells in Lung Adenocarcinoma.Oncogene,2025 May 14

圖源:10.1038/s41388-025-03435-8[1]
福建醫科大學附屬第二醫院曾奕明/徐源課題組在《Oncogene》雜志發表研究,揭示內質網應激降解蛋白-3(Derlin-3)在肺腺癌(LUAD)腫瘤微環境中的新機制。研究發現Derlin-3在LUAD中高表達,主要富集于CD138+漿細胞中,通過靶向Hrd1/p38/PRDM1信號軸,調控漿細胞內質網應激和IgG4分泌。異常的IgG4進一步促進腫瘤微環境中巨噬細胞向M2表型極化,介導LUAD的免疫逃逸。該研究闡明了Derlin-3在LUAD腫瘤微環境中的作用機制,為腫瘤免疫治療提供了潛在新靶點。
02.靶點 KDM4C
應用:乳腺癌治療
來源:KDM4C inhibition blocks tumor growth in basal breast cancer by promoting cathepsin L-mediated histone H3 cleavage.Nat Genet,2025 Jun
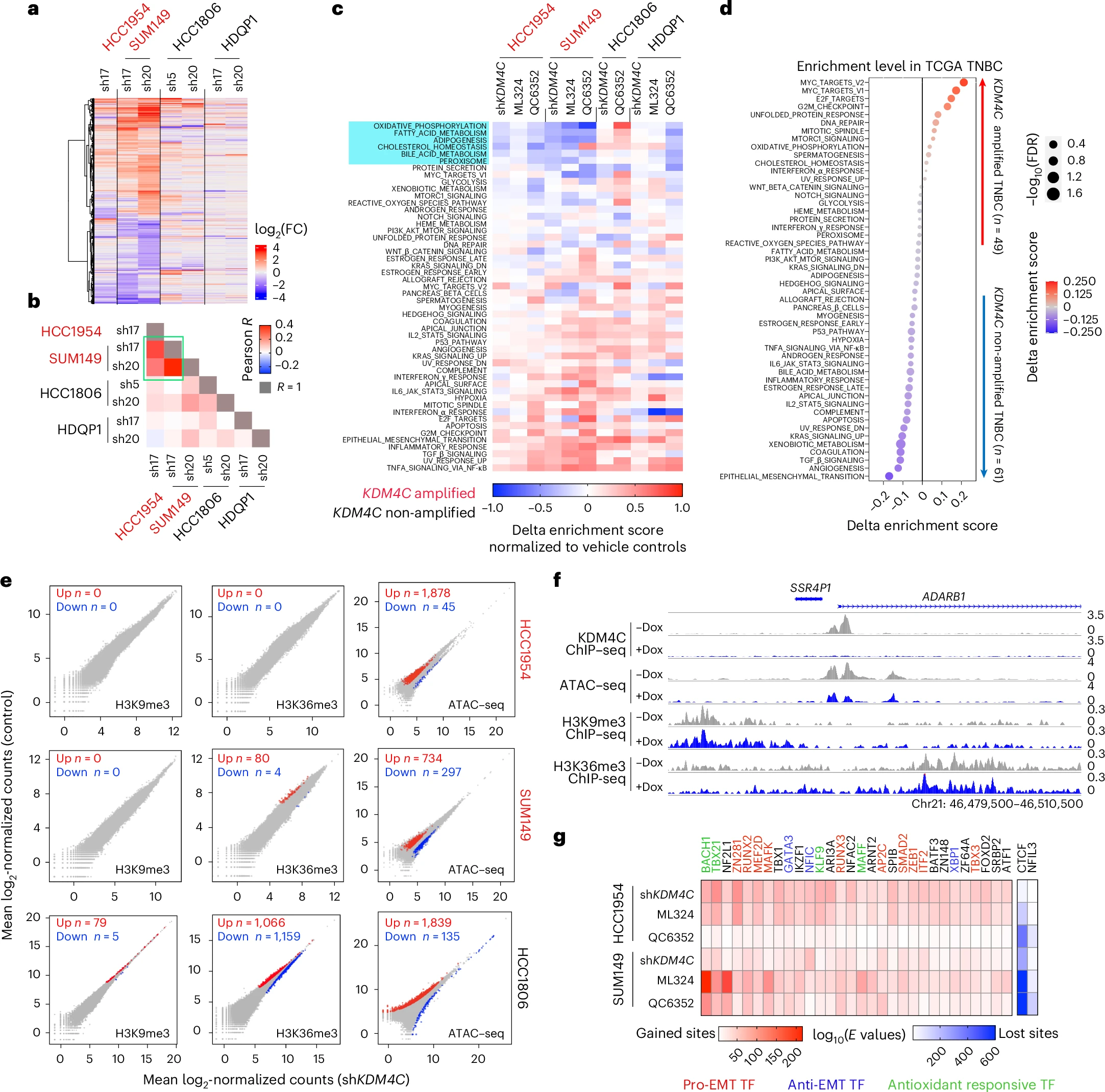
圖源:10.1038/s41588-025-02197-z[2]
美國哈佛醫學院Kornelia Polyak課題組在《Nature Genetics》發表研究,揭示了KDM4C去甲基化酶在基底樣乳腺癌中通過調控組蛋白尾端剪切促進腫瘤生長的新機制。研究發現,KDM4C通過去甲基化轉錄因子GRHL2,抑制CTSL介導的組蛋白H3 N端尾部剪切,進而維持癌細胞的氧化還原平衡,促進腫瘤生長。KDM4C抑制可誘導組蛋白H3剪切,限制谷胱甘肽合成,增強氧化應激,抑制腫瘤。此外,聯合靶向KDM4C和GSH合成通路可增強化療藥物順鉑的療效,為乳腺癌治療提供了潛在新策略。
03.靶點 RIOK1
應用:肝細胞癌治療
來源:RIOK1 phase separation restricts PTEN translation via stress granules activating tumor growth in hepatocellular carcinoma.Nat Cancer,
2025 Jun 04

圖源:10.1038/s43018-025-00984-5[3]
中國科學技術大學附屬第一醫院劉連新教授團隊在《Nature Cancer》發表研究,揭示了RIOK1相分離在肝細胞癌(HCC)應激適應性調控中的新機制。研究發現,RIOK1在HCC組織中高表達,應激條件下通過NRF2轉錄激活。RIOK1相分離通過抑制IGF2BP1-Tyr396位點磷酸化,促使RIOK1/IGF2BP1/PTEN mRNA復合物被招募至應激顆粒(SGs),抑制PTEN蛋白翻譯,激活磷酸戊糖途徑(PPP),增強細胞保護作用,促進肝癌發生發展及TKIs耐藥。臨床多納非尼耐藥的HCC患者中觀察到RIOK1聚集體及PPP激活。西達本胺(組蛋白去乙酰化酶抑制劑)可下調RIOK1表達,增敏TKIs療效,為HCC治療提供新策略。
04.靶點 CD89
應用:潰瘍性結腸炎治療
來源:Enrichment of human IgA-coated bacterial vesicles in ulcerative colitis as a driver of inflammation.Nat Commun,2025 Apr 29
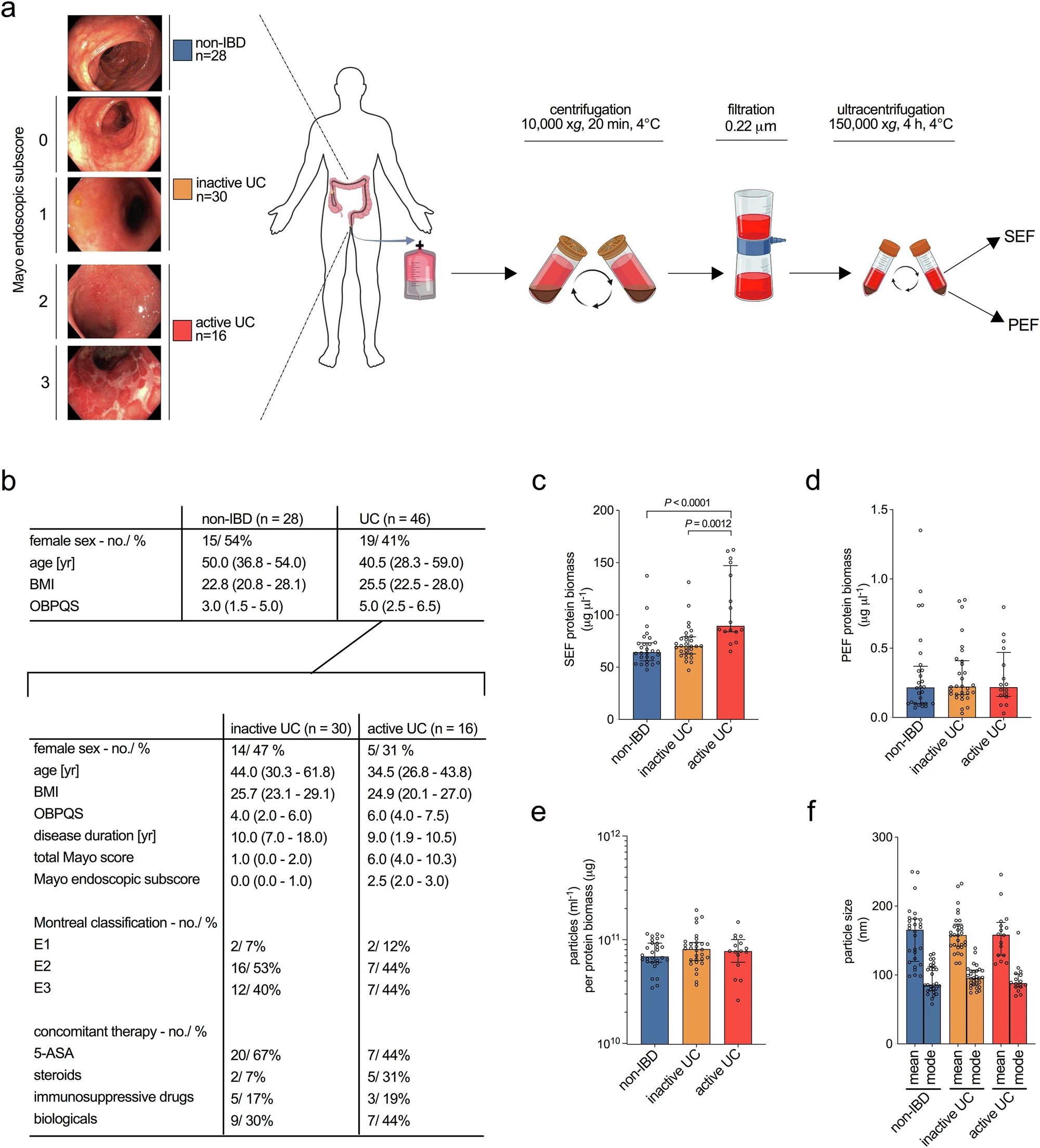
圖源:10.1038/s41467-025-59354-5[4]
格拉茨醫科大學等機構的科學家在《Nature Communications》發表研究,揭示了潰瘍性結腸炎(UC)中細菌外囊泡(BEVs)與免疫球蛋白A(IgA)之間的“危險聯盟”。研究發現,UC患者結腸液及組織樣本中IgA包裹的BEVs濃度顯著更高,這些IgA-BEVs能特異性結合到腸道免疫細胞上的CD89受體,引發強烈炎癥反應。在攜帶人類CD89受體的小鼠模型中,IgA-BEVs顯著加劇腸道炎癥,而未修飾的小鼠或僅含可溶性IgA的小鼠無此反應。這一發現指出IgA-BEVs與CD89受體的相互作用或許是慢性炎癥的核心機制,為UC治療提供了新靶點,未來可通過開發中和抗體或阻斷CD89受體的藥物來阻止其促炎效應。
05.靶點 CREM
應用:癌癥免疫治療
來源:CREM is a regulatory checkpoint of CAR and IL-15 signalling in NK cells.Nature,2025 Jun 04
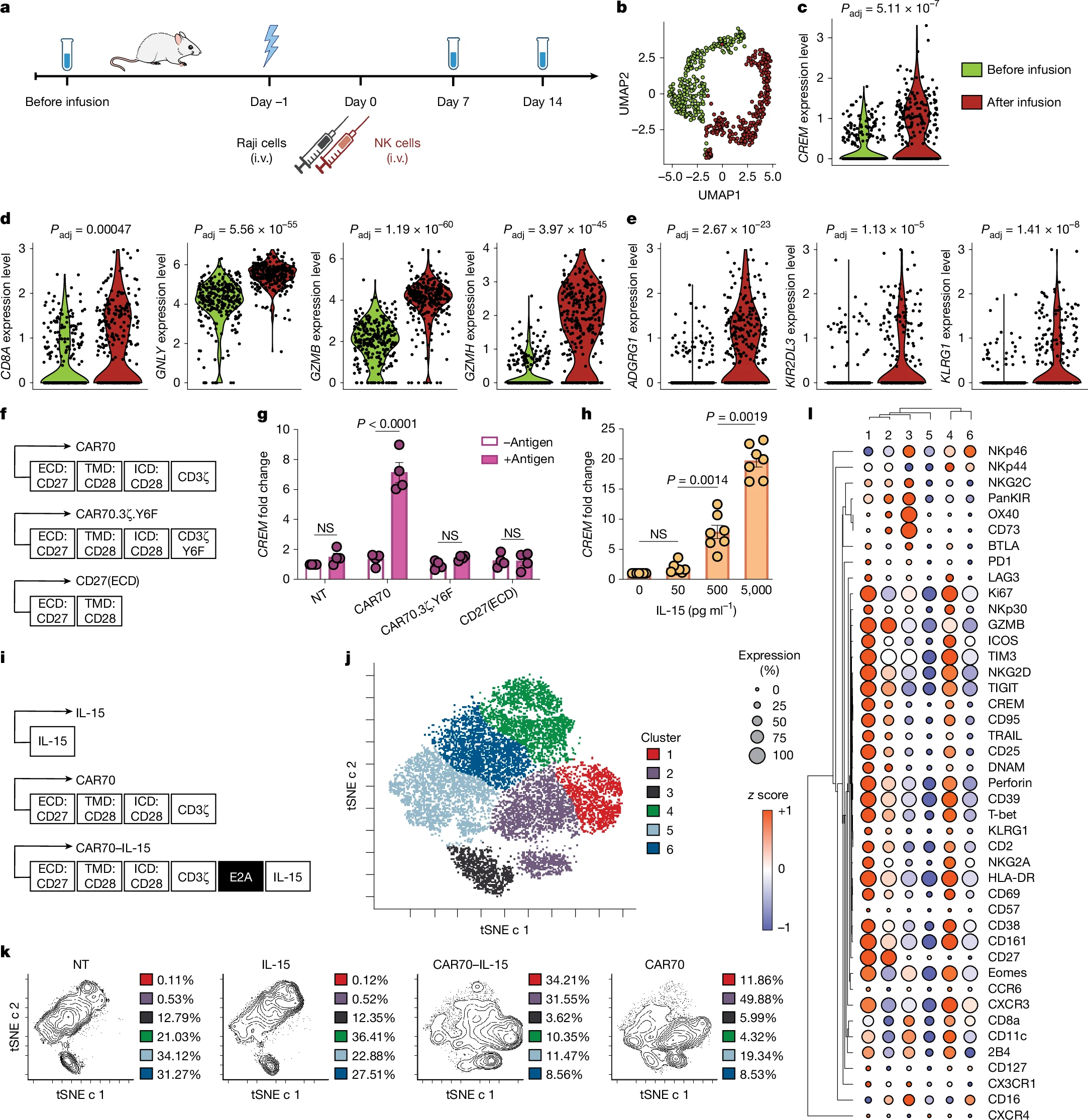
圖源:10.1038/s41586-025-09087-8[5]
《Nature》雜志發表研究揭示cAMP反應元件調節因子(CREM)在CAR-NK細胞中的關鍵作用。CREM是CAR-NK細胞的檢查點調節因子,其表達受CAR信號和IL-15刺激調控,通過PKA-CREB通路誘導。研究發現,CAR激活或IL-15刺激均能迅速上調CREM表達。利用CRISPR-Cas9敲除CREM基因后,CAR-NK細胞的細胞毒性功能顯著增強,細胞因子產生能力提升,且在多種腫瘤模型中展現出更優的抗腫瘤效果,包括更強的增殖和腫瘤浸潤能力。此外,敲除CREM的CAR-NK細胞在小鼠體內未引發明顯毒性反應,顯示出良好的安全性。這一發現為優化CAR-NK細胞療法提供了新策略,也為癌癥免疫治療開辟了新方向。
06.靶點 TRMT6
應用:結直腸癌治療
來源:TRMT6-mediated tRNA m1A modification acts as a translational checkpoint of histone synthesis and facilitates colorectal cancer progression.Nat Cancer,2025 Jun 03

圖源:10.1038/s43018-025-00977-4[6]
tRNA修飾正逐漸成為翻譯重編程的關鍵調控因子,但其在結直腸癌中的作用仍不清楚。最新發表在《自然-癌癥》的研究揭示了tRNA N1-甲基腺苷(m1A)甲基轉移酶TRMT6在結直腸癌中的重要作用。研究人員發現,TRMT6在人類結直腸癌組織中表達上調,且TRMT6高表達與結直腸癌患者的預后不佳相關。從機制上看,TRMT6通過維持TRMT6-TRMT61A復合物的穩定性來提高tRNA m1A水平。靶向抑制結直腸癌TRMT6介導的tRNA m1A修飾,會損害組蛋白mRNA的翻譯,從而限制組蛋白合成并阻礙細胞周期進程。這項研究證實了RMT6介導的tRNA修飾在結直腸癌中的關鍵作用,為癌癥治療提供了新的靶點。
07.靶點 Piezo2
應用:肥胖及相關代謝疾病研究
來源:Piezo2 in sensory neurons regulates systemic
and adipose tissue metabolism.Cell Metab,2025 Apr 01
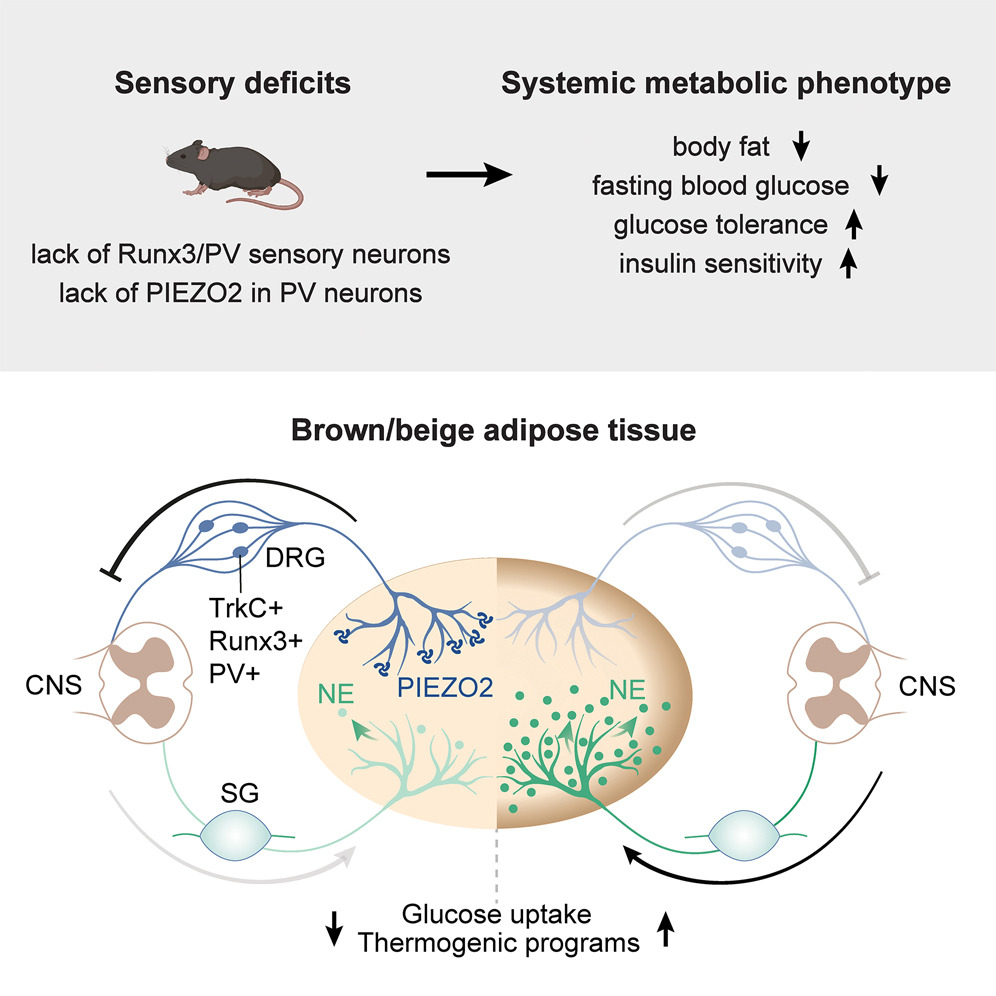
圖源:10.1016/j.cmet.2024.12.016[7]
《細胞-代謝》雜志發表研究,揭示脂肪組織中感知機械刺激的神經細胞可調控脂肪代謝。研究發現,敲除脂肪組織中感覺神經元的Piezo2基因后,小鼠棕色和米色脂肪組織的“褐變”和“米色化”現象增強,脂肪細胞更活躍,解脂和產熱能力提升。即使高脂飲食,小鼠仍保持較低體重,肝臟無脂肪堆積或炎癥。該研究為肥胖及相關代謝疾病的治療提供了新思路。
08.靶點 MEK1/2
應用:帕金森病研究
來源:MEK1/2 inhibitors suppress pathological α-synuclein and neurotoxicity in cell models and a humanized mouse model of Parkinson’s disease.Sci Transl Med,2025 May 14
圖源:10.1126/scitranslmed.adp4625[8]
復旦大學魯伯塤課題組聯合中國科學院上海有機化學研究所劉聰研究員和復旦大學華山醫院王堅教授在《Science Translational Medicine》發表研究,發現MEK1/2是調控α-突觸核蛋白(αsyn)水平的新因子,揭示了MEK1/2抑制劑的分子機制。研究通過工具化合物庫篩選,證實MEK1/2抑制劑可降低細胞內αsyn水平,其作用機制包括促進TFEB核內表達激活自噬降解可溶性αsyn,以及抑制PLK2激酶mRNA水平減少病理性αsyn生成。團隊還構建了人SNCA敲入小鼠模型,驗證了口服MEK1/2抑制劑在挽救多巴胺能神經元死亡、改善行為學表型及降低病理性αsyn方面的顯著療效,為帕金森病的治療提供了新思路。
推薦產品
| 靶點 | 重組蛋白 | 貨號 |
| CREM | Recombinant Mouse cAMP-responsive element modulator (Crem) | CSB-MP005961MO |
| DERL3 | Recombinant Human Derlin-3 (DERL3), partial | CSB-MP836283HU1 |
| FCAR | Recombinant Human Immunoglobulin alpha Fc receptor (FCAR), partial | CSB-MP008531HU1 |
| KDM4C | Recombinant Human Lysine-specific demethylase 4C (KDM4C), partial | CSB-MP872489HU |
| MAP2K1 | Recombinant Mouse Dual specificity mitogen-activated protein kinase kinase 1 (Map2k1) | CSB-MP013409MO |
| PIEZO2 | Recombinant Human Piezo-type mechanosensitive ion channel component 2 (PIEZO2), partial | CSB-EP887983HU |
| RIOK1 | Recombinant Human Serine/threonine-protein kinase RIO1 (RIOK1) | CSB-EP871562HU |
| TRMT6 | Recombinant Human tRNA (adenine (58)-N (1))-methyltransferase non-catalytic subunit TRM6 (TRMT6) | CSB-MP891716HU |
參考文獻
[1]Derlin-3 Manipulates the Endoplasmic Reticulum Stress and IgG4 Secretion of Plasma Cells in Lung Adenocarcinoma.Oncogene,2025 May 14
[2]KDM4C inhibition blocks tumor growth in basal breast cancer by promoting cathepsin L-mediated histone H3 cleavage.Nat Genet,2025 Jun
[3]RIOK1 phase separation restricts PTEN translation via stress granules activating tumor growth in hepatocellular carcinoma.Nat Cancer,2025 Jun 04
[4]Enrichment of human IgA-coated bacterial vesicles in ulcerative colitis as a driver of inflammation.Nat Commun,2025 Apr 29
[5]CREM is a regulatory checkpoint of CAR and IL-15 signalling in NK cells.Nature,2025 Jun 04
[6]TRMT6-mediated tRNA m1A modification acts as a translational checkpoint of histone synthesis and facilitates colorectal cancer progression.Nat Cancer,2025 Jun 03
[7]Piezo2 in sensory neurons regulates systemicand adipose tissue metabolism.Cell Metab,2025 Apr 01
[8]MEK1/2 inhibitors suppress pathological -synuclein and neurotoxicity in cell models and a humanized mouse model of Parkinson’s disease.Sci Transl Med,2025 May 14
*免責聲明:華美生物內容團隊僅是分享和解讀公開研究論文及其發現,本文僅作信息交流,文中觀點不代表華美生物立場,請理解。
上一篇: MICA:腫瘤免疫監視的關鍵調節分子及其治療靶點潛力
下一篇: LYPD3:實體瘤治療的潛力之星













